EL ÁTOMO
Es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
• Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 × 10–27 kg y una masa 1837 veces mayor que la del electrón.
• Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 × 10–27 kg).
• Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 × 10–27 kg).
• Alrededor del núcleo se encuentran los electrones que son partículas elementales de carga negativa y con una masa de 9,10 × 10–31 kg
Identificación de los átomos
Los átomos se identifican por el número de protones que contiene su núcleo, ya que éste es fijo para los átomos de un mismo elemento. Por ejemplo: Todos los átomos de hidrógeno tienen 1 protón en su núcleo, todos los átomos de oxígeno tienen 8 protones en su núcleo, todos los átomos de hierro tienen 26 protones en su núcleo, ..., y esto permite clasificarlos en la tabla periódica por orden creciente de este número de protones.
Número atómico: Es el número de protones de un átomo. Se representa con la letra Z y se escribe como subíndice a la izquierda del símbolo del elemento: ZX.Ejemplos: 1H, 8O, 26Fe.
Número másico: Es la suma del número de protones y del número de neutrones de un átomo. Se representa con la letra A y se escribe como superíndice a la izquierda del símbolo del elemento: AX.
Ejemplos: 1H, 8O, 26Fe.
De esta manera se pueden identificar el número y tipo de partículas de un átomo:
3
1H ; Este átomo tiene Z = 1 y A = 3. Por tanto, tiene 1 protón, 3 - 1 = 2 neutrones y, como es neutro, tiene 1 electrón.
Si tenemos un ion habrá que sumar o restar electrones a los que tendría si el átomo fuese neutro.
- Si es un catión habrá perdido electrones y hay que restar el número que aparezca con la carga positiva:
25
12Mg+2 ; Este átomo tiene Z = 12 y A = 25. Por tanto, tiene 12 protones, 25 - 12 = 13 neutrones y, al ser positivo, tendrá 2 electrones menos de los que tendría neutro: 12 - 2 = 10 electrones.
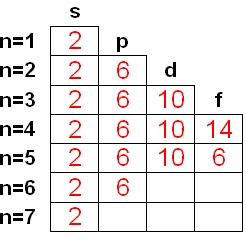
La configuración electrónica
Diagrama del video que indica el orden de llenado de los niveles energéticos de un átomo.
Los electrones están distribuidos en cada átomo en niveles o capas de energía. Los elementos de un mismo período tienen todos el mismo número de niveles electrónicos (completos o no), y este número coincide con el número del período. El número máximo de electrones que caben en un nivel es 2n2, siendo n el número de nivel.
Cada nivel o capa de energía puede tener uno o más subniveles con distinto número de electrones.
Los subniveles de tipo s pueden tener uno o dos electrones; los subniveles de tipo p, de uno a seis electrones, y los subniveles de tipo d, de uno a diez electrones. También puede haber subniveles de tipo f que pueden tener de uno a catorce electrones, para capas o niveles superiores a tres.
Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno, al 7, el más externo.
A su vez, cada nivel tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f.
En cada subnivel hay un número determinado de orbitales que pueden contener, como máximo, 2 electrones cada uno. Así, hay 1 orbital tipo s, 3 orbitales p, 5 orbitales d y 7 del tipo f. De esta forma el número máximo de electrones que admite cada subnivel es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x 5); 14 en el f (2 x 7).
La distribución de orbitales y número de electrones posibles en los 4 primeros niveles se resume en la siguiente tabla:
Regla de exclusión de Pauli
Esta regla nos dice que en un estado cuántico sólo puede haber un electrón. De aquí salen los valores del espín o giro de los electrones que es 1/2 y con proyecciones .
También que en una orientación deben de caber dos electrones excepto cuando el número de electrones se ha acabado por lo cual el orden que debe de seguir este ordenamiento en cada nivel es primero los de espín positivo (+1/2) y luego los negativos.
Ejercicios
Esta regla nos dice que en un estado cuántico sólo puede haber un electrón. De aquí salen los valores del espín o giro de los electrones que es 1/2 y con proyecciones .
También que en una orientación deben de caber dos electrones excepto cuando el número de electrones se ha acabado por lo cual el orden que debe de seguir este ordenamiento en cada nivel es primero los de espín positivo (+1/2) y luego los negativos.
Ejercicios
Escribe la configuración electrónica del Radio (Z = 88). ¿Cuáles son los electrones de interés en química?
Escribe la configuración electrónica del 74W. ¿Cuáles son los electrones de interés en química?
Escribe la configuración electrónica del 94Pu. ¿Cuáles son los electrones de interés en química
Escribe la configuración electrónica del 52Te2-. ¿Cuáles son los electrones de interés en química
Escribe la configuración electrónica del 78Pt2+. ¿Cuáles son los electrones de interés en química?
Solución
1. Configuración electrónica del Ra: Z = 88 quiere decir que tiene 88 e-
La configuración electrónica es: 1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 f14 5 s2 p6 d10 6 s2 p6 7 s2
Electrones de interés en química: 7 s2
2. Configuración electrónica del 74W: Z=74 o sea, tiene 74 e-
Configuración electrónica: 1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 f14 5 s2 p6 6 s2 5 d4
Electrones de interés en química: 6 s2 5 d4
3. Configuración electrónica del 94Pu: Z=94, o sea, tiene 94 e-
Configuración electrónica: 1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 f14 5 s2 p6 d10 6 s2 p6 7 s2 5 f 6
Electrones de interés en química: 7 s2 5 f 6
4. Configuración electrónica del 52Te2-: Z=52, carga -2 quiere decir que tiene
2 e- de más, o sea, tiene 52 + 2 =54 e-
Configuración electrónica: 1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 5 s2 p6
Electrones de interés en química: 5 s2 p6
5. Configuración electrónica del 78Pt2+: Z=78, carga +2 quiere decir que tiene
2 e- de menos, o sea, tiene 78 - 2 =76 e-
Configuración electrónica:
1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 f14 5 s2 p6 6 s2 5 d6
Electrones de interés en química: 6 s2 5 d6
EVALUACIÓN _ CONFIGURACIÓN ELECTRÓNICA
VIDEOS